引言
2021年11月,国际标准化组织(ISO)发布了ISO/DIS 10993-17:2021(E) [1]***新修订草案--“Biological evaluation of medical devices - Part 17: Toxicological risk assessment of medical device constituents”(ISO/FDIS 10993-17 医疗器械的生物学评估 — 第 17 部分:医疗器械成分的毒理学风险评估),该标准即将正式发布实施。
毒理学风险评估作为医疗器械生物学评价的重要环节之一,标准的修订对医疗器械安全性评价的影响意义重大。对比现行的ISO 10993-17[2]标准,新版修订草案有哪些变化?
1、新旧版本对比(2002版 vs 2021版草案)
现行的ISO 10997-17 :2002版主要描述医疗器械可沥滤物的人体允许限量(AL)的确定方法,未能涵盖毒理学风险评估的内容。
ISO/DIS 10993-17:2021(E)***新修订草案扩展了之前的版本,分别从以下四大部分对医疗器械中可浸提物(或可沥滤物)的毒理学风险评估进行了全面阐述:

2、新增术语

3、对新增术语的重点阐述

毒理筛选阈值(TSL)用于判断已存在或可提取的鉴定化合物的总量是否会引起遗传毒性、致癌性、全身毒性(如急性、亚急性、亚慢性、慢性)或生殖/发育毒性。
TSL值可有效减免不必要评估的物质,更好的识别化学组分的毒理学风险。当一种化合物的总量(TQ)低于指定的TSL值时,可以判定为不具有毒理风险,且不需要对这些危害进行进一步的毒理风险评估;否则,需要进行毒理风险评估。
不适用的情况:
1、由刺激引起的危害;
2、关注队列物质(CoC);
3、因化学鉴定信息不充分的成分;
4、应用于新生儿(包括早产儿或非常小的婴儿-16周龄)的持久接触器械;
5、应用于吸入器械中的挥发性化合物。

评估器械中存在安全风险的化学组分时,应用数据质量高、产品信息相关、敏感的毒性数据——如,无可观察到不良反应水平(NOAEL)或***低可观察不良反应水平(LOAEL)等——作为关键评估终点POD,同时采用修正因子MF(种间/种内差异、途径转换、暴露时间、数据质量等不确定因素)进行TI值推导。以此评估各个接触时间段的TI值。

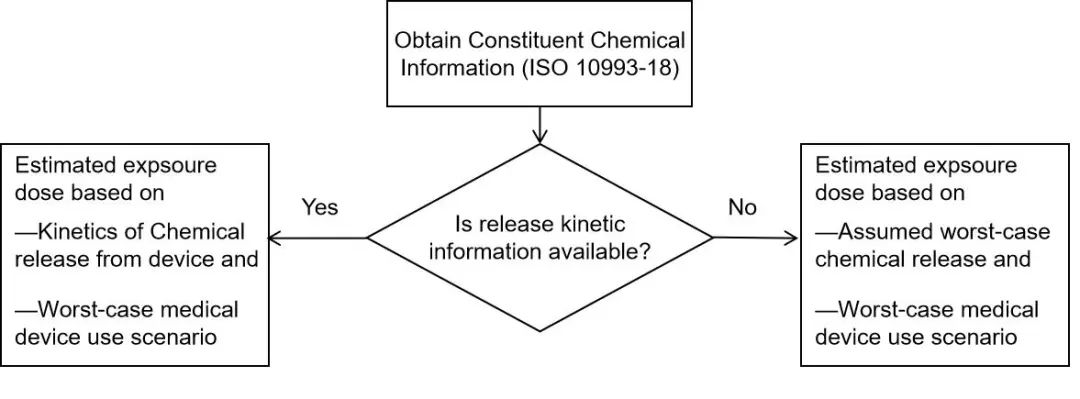
每日接触或进入人体的化合物的***坏暴露量引入释放动力学信息概念,即基于释放动力学信息时,模拟浸提动态释放过程中的单日***高剂量(HQ),以评估各个接触时间段的***大估计暴露量(EEDmax)。
而缺少释放动力学信息时,根据化学表征测试中得到的浸提剂量(TQ),以***低接触天数评估各个接触时间段的***大估计暴露量(EEDmax)。该法更为合理的进行了暴露剂量预测。
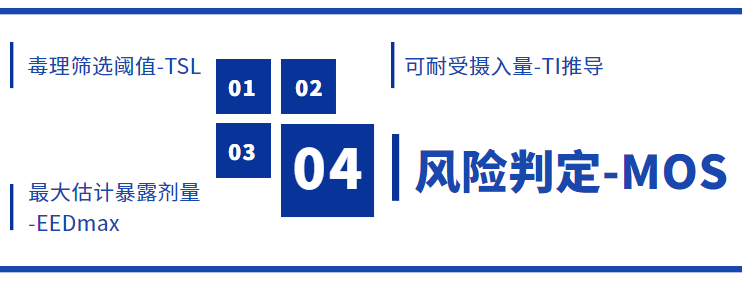
MOS作为健康风险的衡量指标,MOS值可以根据每个暴露期的***坏暴露量与TI或TTC进行比较所得,当MOS>1.0认为化合物的暴露量对健康没有明显的危害。否则,需要参照 ISO 10993-1[3]和 ISO 14971[4]进行进一步的毒理风险分析及毒理评估。
![]()
4、总结
上述为ISO/DIS 10993-17:2021(E)***新修订草案的关键内容。
与2002版法规相比,新版修订草案对毒理风险评估更为系统、完善,由“人体允许限量(AL)的确立”涵盖***整个“毒理风险评估”。

关于我们
微谱在医疗器械领域致力于构建一个医械产品全生命周期内的创新服务平台,为医疗器械的设计开发、非临床研究、临床评价与注册申报提供专业合规的测试、评价与法规咨询服务,助力医疗器械创新研发与全球申报。
















